Sitio activo
La zona en la que los sustratos y los cofactores se unen a la enzima se llama sitio activo. Es donde tiene lugar la catálisis. El sitio activo se suele parecer a un bolsillo, y está formado por varios aminoácidos que pueden tener interacciones específicas con el sustrato [1]. La figura 1 muestra el sitio activo de la alcohol deshidrogenasa, al que se une el NAD+. El residuo de aminoácido 47, que es responsable del rubor facial transitorio, se localiza en este sitio activo, y es un aminoácido importante para la unión con el NAD+. Si una mutación provoca una sustitución de aminoácido en este residuo, los parámetros cinéticos podrían alterarse, que es lo que sucede en el rubor facial transitorio.
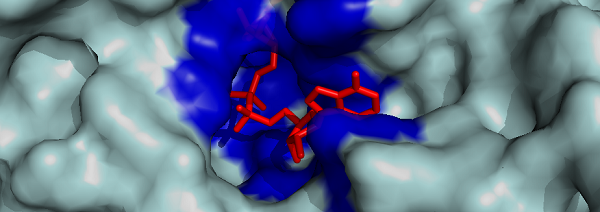
Figura 1: Modelo de la superficie de la alcohol deshidrogenasa, en el que se ve el sitio activo (en azul) que permite la unión del NAD+ (en rojo). Generado con PyMOL a partir de la entrada 1HSZ del PDB.
Referencias
- Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (2008). Principles of Biochemistry (5th ed.). New York, NY: W.H. Freeman and Company. ISBN 978-0-7167-7108-1.