ADH
La alcohol deshidrogenasa (ADH) es la enzima que cataliza la primera fase del metabolismo del alcohol en los humanos.
La ADH cataliza la oxidación de una amplia gama de sustratos que contienen grupos hidroxilo, incluido el etanol. En el caso del etanol, el alcohol se transforma a acetaldehído, otro compuesto tóxico, que luego se metaboliza todavía más.
Para llevarse a cabo, la reacción requiere un agente oxidante llamado «dinucleótido de nicotinamida y adenina» (NAD+). El NAD+ es una coenzima que actúa como aceptor de electrones, aceptando dos electrones y un H+ del etanol [1]. De esta forma, la ADH cataliza la siguiente reacción:
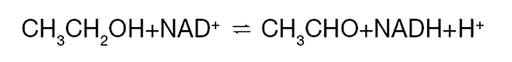
Figura 1: Fórmula química de una reacción en la que se usa la enzima ADH. Debajo de esta, se puede ver la estructura de la alcohol deshidrogenasa ADH1B*1 (de la entrada 1HSZ del PDB).
Al realizar ensayos de cinética, es importante empezar a medir inmediatamente después de añadir la enzima, pues esta reacción ocurre nada más mezclarse la ADH con el NAD+ y el etanol.
Rubor facial transitorio
Los humanos tienen diferentes versiones (isoenzimas) de la ADH. Dos de estas, la ADH1B*1 y la ADH1B*2, se diferencian solo en un residuo de aminoácido; no obstante, estas dos isoenzimas muestran diferencias significativas en sus propiedades cinéticas. La ADH1B*1 tiene un residuo de arginina en la posición 47, mientras que la ADH1B*2 tiene un residuo de histidina en esa posición. La ADH1B*2 es más común entre personas del sudeste asiático, mientras que la ADH1B*1 es común entre personas caucásicas [2,3].
Las diferencias cinéticas se deben a las propiedades químicas de la arginina y de la histidina. La arginina de la ADH1B*1 establece enlaces de hidrógeno con el grupo pirofosfato del NAD+. En cambio, el residuo de histidina de la ADH1B*2 no es capaz de formar enlaces tan fuertes como la arginina. Esto quiere decir que la ADH1B*2 no se une al NAD+ tan firmemente como la ADH1B*1, lo que desemboca en un valor superior de Km para ADH1B*2. El paso que determina la velocidad de la reacción en su conjunto es la disociación del NADH. En consecuencia, el número de recambio y la Vmáx son mayores, ya que el NADH no se une con tanta fuerza. Además, como el valor de pKa de la histidina es menor que el de la arginina, el pH óptimo de la ADH1B*2 (8,5) es menor que el de la ADH1B*1 (10,0) [4].
Los individuos que poseen la isoenzima ADH1B*2 experimentan una enfermedad conocida como «rubor facial transitorio». Esta enfermedad causa rubor y otros síntomas normalmente asociados con la resaca solo por tomar una pequeña cantidad de alcohol. Estos síntomas los provoca un nivel elevado de acetaldehído en la sangre, desencadenado por una actividad mayor de la ADH1B*2 que de la ADH1B*1. Así, la simple sustitución de un aminoácido en ADH1B*2, causada por una mutación en el ADN, da lugar a la enfermedad del rubor facial transitorio [5].
Referencias
-
Hurley, T.D., Bosron, W.F., Stone, C.L. and Amzel, L.M. (1994) Structures of three human ß alcohol dehydrogenase variants. J. Mol. Biol. 239, 415-429.
-
Shou-Lun Lee, Gar-Yang Chau, Chung-Tay Yao, Chew-Wun Wu, and Shih-Jiun Yin (2006) Functional assessment of Human Alcohol Dehydrogenase Family in Ethanol Metabolism: Significance of First-Pass Metabolism. Alcohol. Clin. Exp. Res. 30, 1132-1142.
-
Jornvall H., Hempel J., Vallee, B.T., Bosron, W.F. and Li, T.K. (1984) Human liver alcohol dehydrogenase: Amino acid substitution in the ß2ß2 Oriental isozyme explains functional properties, establishes an active site structure, and parallels mutational exchanges in the yeast enzyme. Proc. Natl. Acad. Sci. USA, 81, 3024-3028.
-
Thomasson, H.R., Crabb, D.W., Edenberg, H.J., and Li, T.K (1993) Alcohol and Aldehyde Dehydrogenase Polymorphisms and Alcoholism. Behav. Genet. 23, 131-136.