Haloalcanos
Los haloalcanos son compuestos hidrocarburos en los que uno o más de los átomos de hidrógeno han sido sustituidos por un átomo halógeno (yodo, bromo, cloro o flúor). La incorporación de átomos halógenos a un hidrocarburo cambia las propiedades físicas del compuesto, afectando al tamaño, a la electronegatividad y a la longitud y fuerza del enlace.
Los haloalcanos son sustratos ideales para aquellas reacciones que necesitan un buen grupo saliente. La alta reactividad de los haloalcanos se puede explicar en términos de la naturaleza del enlace C-X. La diferencia de electronegatividad entre el carbono y el átomo de halógeno crea un enlace altamente polarizado, que da como resultado un carbono ligeramente electropositivo y un halógeno ligeramente electronegativo. Esta deficiencia de electrones en el carbono se vuelve el foco del ataque nucleofílico, convirtiendo a los haloalcanos en excelentes sustratos para la sustitución nucleofílica y las reacciones de eliminación.
Los haloalcanos se clasifican según la conectividad del átomo de carbono que transporta al átomo halógeno:
Primarios: el carbono unido al halógeno solo está unido a un grupo alquilo más.
Secundarios: el carbono unido al halógeno está unido a dos grupos alquilos más.
Terciarios: el carbono unido al halógeno está unido a tres grupos alquilos más.
En general, debido al volumen estérico de los tres grupos alquilos que rodean al halógeno en los haloalcanos terciarios, estos son mucho menos reactivos que otros tipos y puede que solo participen en reacciones de eliminación. La tendencia de la reactividad general de los distintos tipos de haloalcanos es Primarios > Secundarios > Terciarios. No obstante, esta tendencia se vuelve inversa si la velocidad de una reacción específica (por ejemplo, una reacción SN1) viene determinada por la formación del carbocatión más estable. En estas situaciones, se favorecen mucho los haloalcanos terciarios, puesto que formarían el reactivo intermedio más estable.
Otros factores (como qué enlace C-X ha de romperse) también contribuyen a la reactividad de los haloalcanos y a la probabilidad de que la reacción ocurra o no.
Al seleccionar el mejor halogenuro para dar comienzo a una reacción, tenemos que considerar también la fuerza del enlace C-X que estamos intentando romper. Los enlaces C-F son tan fuertes que los fluoroalcanos rara vez reaccionan, por lo que no son buenos materiales para comenzar la reacción. La fuerza del enlace C-X decae conforme descendemos por la tabla periódica, lo que quiere decir que el yoduro, de enlaces débiles, es el más dispuesto a salir del grupo, seguido de cerca por el bromuro.
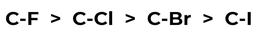
Figura 1: Tendencia de la fuerza del enlace C-X.