Estructuras de Lewis
Formar una unión química (iónica y covalente) supone o transferir o compartir electrones. Una forma de visualizar los electrones de la capa de valencia en una unión química son las estructuras de Lewis. Este concepto fue introducido por Gilbert N. Lewis en 1916.
En las estructuras de Lewis, cada electrón de la capa de valencia se representa como un solo punto. Los pares de electrones no compartidos se muestran como dos puntos alrededor del símbolo del elemento. A veces, se utiliza una línea para indicar un par de electrones no compartidos o compartidos.
De acuerdo con el concepto de la estructura de Lewis, la formación de una unión química entre el potasio (K) y el cloro (Cl), también puede formularse de esta forma:
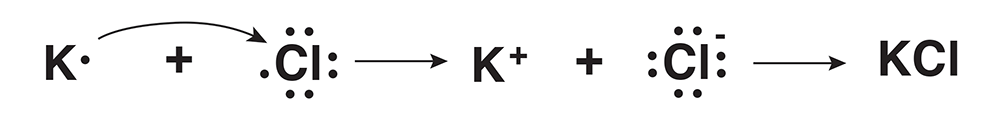
Un ejemplo de la estructura de Lewis de un compuesto covalente es el Cl2:
