Estructuras de Lewis
Las estructuras de Lewis son representaciones visuales de estructuras químicas como la que puedes ver en el ejemplo de abajo. Las estructuras de Lewis nos muestran cómo se pueden unir los elementos y nos sugieren cómo podrían reaccionar los compuestos resultantes a otros compuestos.
En la estructura de Lewis se debe representar todos los electrones de valencia de cada elemento. Los pares de electrones que forman enlaces se suelen indicar con una línea recta. Los electrones que no forman enlaces se dibujan como pares de puntos (estos son los pares solitarios).
Puesto que las estructuras de Lewis nos muestran la valencia, también nos indican si un elemento puede unirse a otros mediante enlaces covalentes o si su esfera de coordinación está ya saturada.
Por ejemplo, por su configuración electrónica, sabemos que la valencia del carbono es 4. Así, en la estructura de Lewis del tetracloruro de carbono podemos ver que la esfera de coordinación del carbono está saturada. Por supuesto, esto explica por qué se trata de un compuesto muy estable.
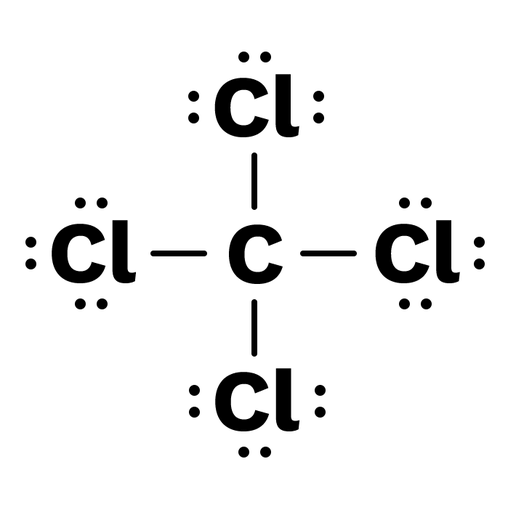
Imagen 1: La estructura de Lewis del tetracloruro de carbono
Las estructuras de Lewis no solo nos informan de las valencias, sino que también nos dan una pista sobre las geometrías tridimensionales de los compuestos.