Reacciones de los hidrocarburos
Los alcanos y otros hidrocarburos arden al aire para producir dióxido de carbono y agua, liberando calor en una reacción de combustión. Si los alcanos se mezclan con oxígeno a temperatura ambiente, no ocurre nada; sin embargo, si se introduce una chispa o llama, se produce una fuerte reacción de combustión. Puesto que la combustión de los hidrocarburos es altamente exotérmica, se utilizan mucho como combustibles.

Figura 1: Ecuación de combustión.
Los alcanos son relativamente no reactivos como compuestos, pero pasan por algunas reacciones. Además de la combustión, los alcanos pueden reaccionar consigo mismos en presencia de un catalizador, y pasar por una reacción de isomerización que convierte a los alcanos no ramificados en sus isómeros ramificados en cadena. Los alcanos también reaccionan con los halógenos, como el bromo y el cloro, pero necesitan energía procedente de un aumento de la temperatura o de luz ultravioleta para iniciar esas reacciones.
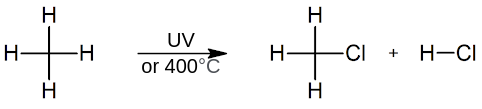
Figura 2: Cloración del metano.
Los alquenos reaccionan con una variedad de compuestos mucho más amplia que los alcanos. La reacción clásica de los alquenos y los alquinos es la reacción de adición. La hidrogenación es la adición del hidrógeno a múltiples enlaces y puede convertir los alquenos en alcanos. La halogenación (la adición de bromo o cloro a los alquenos) puede dar como resultado haloalcanos. La adición de H-X (donde X es un halógeno u otro grupo electronegativo) también se conoce como hidrohalogenación. Los alquenos también pueden unirse en una reacción de polimerización para crear polímeros a partir de monómeros de alqueno individuales.
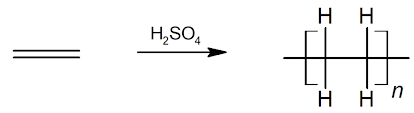
Figura 3: Polimerización de los alquenos.
Los alquinos pasan por muchas reacciones similares a las de los alquenos. La hidrogenación de los alquinos puede controlarse para producir alquenos o alcanos, por medio del ajuste de la estequiometría de la reacción. De manera similar, la adición de otros reactivos al enlace triple de alquino puede controlarse cambiando cuidadosamente los equivalentes reactivos para producir los productos deseados. Por ejemplo, una reacción alquina con bromo puede dar un dihaloalcano o un tetrahaloalcano al cambiarse el número de equivalentes de bromo añadidos.
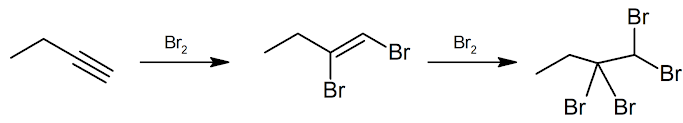
Figura 4: Bromación del but-1-ino.