La reacción SN2
Una reacción SN2 es una reacción de sustitución nucleofílica en la que el paso de determinación de la velocidad involucra dos componentes. El nombre de la reacción se obtiene a partir de la S de 'sustitución', la N de 'nucleófilo' y un 2, que denota el orden cinético de la reacción o número de componentes de la reacción involucrados en el paso limitante de la velocidad.
Una reacción SN2 surge de la combinación de un buen nucleófilo y un sustrato con un centro de reacción electrófilo unido a un buen grupo saliente. Encontramos un ejemplo adecuado en el enlace carbono-halógeno (C-X) que se encuentra en un haluro de alquilo.
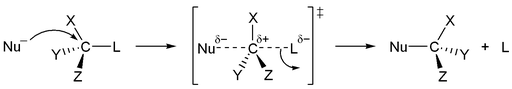
Figura 1: Mecanismo de reacción general SN2: 'L' es el grupo saliente, 'Nu' es el nucleófilo, el carbono parcialmente positivo es un electrófilo.
Las reacciones SN2 son reacciones bimoleculares de un solo paso con pasos coordinados (o simultáneos) de ruptura y formación de enlaces. Dado que las reacciones SN2 tienen lugar en un paso, una característica que las define es que el mecanismo no ocurre a través de un intermediario de reacción. En cambio, el nucleófilo se coordina con el centro de reacción para formar un enlace al mismo tiempo que se rompe el enlace C-X. Esto da como resultado la inversión de la configuración en el estereocentro de reacción.
Factores que afectan una reacción SN2:
Nucleófilo: Los mejores nucleófilos son fuertes, cargados negativamente y posean una energía elevada. Dado que el nucleófilo es un reactivo, en un diagrama de energía un buen nucleófilo elevaría la energía de los reactivos. Al aumentar la energía de los reactivos, se reduce la energía de activación. La energía de activación es la diferencia de energía entre los reactivos y el estado de transición.
Disolvente: La velocidad de una reacción SN2 está influenciada en gran medida por el disolvente en el que tiene lugar. Los disolventes próticos (como el agua o los alcoholes con capacidad para donar enlaces de hidrógeno) disminuyen el poder del nucleófilo debido a un efecto de solvatación. Los disolventes próticos reducen la energía del nucleófilo, por lo tanto, la energía de los reactivos es menor y la energía de activación aumenta. Las fuertes interacciones de enlaces de hidrógeno entre los protones del solvente y los pares solitarios altamente reactivos en el nucleófilo forman una «capa» o «jaula» que evita que el nucleófilo reaccione. Las reacciones SN2 son más rápidas en disolventes apróticos polares (como la acetona) que carecen de capacidad de enlace de hidrógeno.
Grupo saliente: El mejor grupo saliente es el que reduce la energía del estado de transición; así, la energía de activación se reduce.
Efectos estéricos: Dado que las reacciones SN2 dependen en gran medida del fácil acceso al centro de reacción, los efectos estéricos son un factor importante que podría impedir la reacción. Un haluro de alquilo voluminoso aumenta la energía del estado de transición y, por lo tanto, aumenta la energía de activación. Al seleccionar un haluro de alquilo con menos impedimentos estéricos y un nucleófilo fuerte, es posible favorecer la reacción SN2 sobre reacciones potencialmente competitivas, como la reacción SN1 o las reacciones de eliminación.