Preparación de muestras para Western blot
Hay distintos métodos para preparar muestras, dependiendo de si la proteína es extracelular o intracelular. Las proteínas intracelulares son más difíciles de extraer y la manera de proceder con ellas ha de diseñarse con cuidado.
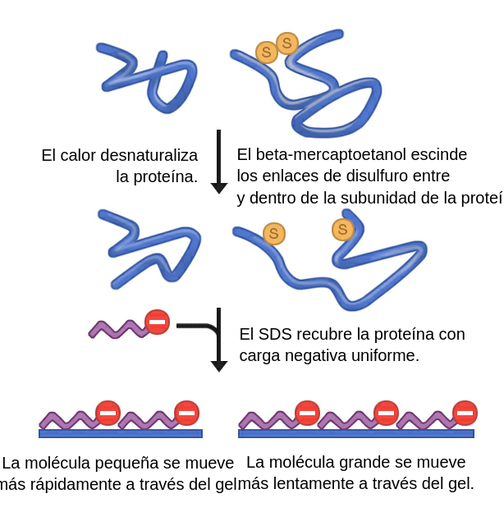
Figura 1: Preparación de muestras para Western blot.
La composición celular de cada organismo se compone de una compleja muestra de moléculas que incluye proteínas, ácidos nucleicos, polisacáridos y sal. Estas moléculas pueden interferir con el método Western blot, de ahí la importancia de la preparación de muestras. Se puede realizar mediante muchos métodos de disrupción celular. Normalmente, cuando se trata de células de mamíferos, se puede eliminar la membrana celular por lisis por detergente, lisis por congelación/descongelación u homogeneización mecánica y sonicación.
Tras la extracción, la muestra proteica se hierve en una solución que contiene una tinción (azul de bromofenol), un agente reductor del disulfuro (2-mercaptoetanol) y detergente (dodecil sulfato sódico / SDS). La hervir la proteína, esta se desnaturaliza y se despliega. El 2-mercaptoetanol evita que se vuelvan a formar los enlaces de disulfuro e interrumpe así la estructura cuaternaria y terciaria de la proteína, de tal manera que crea cadenas polipeptídicas lineales. El dodecil sulfato sódico confiere a la proteína una carga negativa.